Voláteis de diferentes ínstares de abelhas trabalhadoras, larvas e sua alimentação
Artigo retirado do: Link
Resumo: (E)-β-Ocimeno foi o único produto químico volátil emitido por trabalhadores inteiros e vivos larvas de Apis mellifera L. quando amostradas na fase vapor. Além do (E)-β-ocimeno, há evidência da existência de outros voláteis, mas as mudanças na sua composição e conteúdo permanecem desconhecidos durante o desenvolvimento larval, assim como suas diferenças entre as larvas e os alimentos larvais.
Nós investigamos componentes voláteis de larvas de operárias e alimentos larvais usando dinâmica de fase sólida extração (SPDE) acoplada à cromatografia gasosa-espectrometria de massa (GC-MS). Nove compostos foram identificados com certeza e seis provisoriamente, incluindo terpenóides, aldeídos, hidrocarbonetos, um éster e uma cetona. O conteúdo de voláteis nas larvas operárias de segundo ínstar difere muito
daqueles em larvas de outros estágios. Isto é atribuído principalmente aos terpenóides, que resultaram na larvas operárias de segundo ínstar com quantidades significativamente maiores de voláteis em geral. Comida larval continha quantidades significativamente maiores de aldeídos e hidrocarbonetos do que as larvas correspondentes do quarto ao quinto ínstar. Descobrimos substâncias voláteis nas larvas das operárias e nos seus alimentos que nunca foram relatados antes; também determinamos as mudanças no conteúdo desses voláteis durante o desenvolvimento larval.
- Introdução
Voláteis ocorrem em colônias de abelhas como uma mistura complexa, determinada por feromônios produzidos pelas abelhas, e outros produtos químicos emitidos pela cera de abelha, mel, pólen e alimento larval [1]. Esses voláteis foram identificados como álcoois, aldeídos, compostos benzenoides, ácidos carboxílicos, hidrocarbonetos, cetonas e terpenoides [1].
Voláteis em colônias de abelhas são facilmente recebidos pelas abelhas através da recepção antenal, às vezes a longas distâncias. Portanto, usar voláteis é um meio eficiente de moderar comportamentos sociais das abelhas. Com relação aos voláteis que mantêm a coesão social, a maioria vem de abelhas operárias adultas, como o feromônio de alarme que induz o comportamento defensivo das abelhas [2], o feromônio de Nasanov que desencadeia a agregação [3], e outros voláteis que transmitem sinais de reconhecimento. Poucos voláteis são detectados especificamente em rainhas [4].
Muito pouco esforço foi feito para determinar os voláteis emitidos diretamente por larvas de abelhas vivas e intactas. Em contraste, os produtos químicos não voláteis das larvas de abelhas são amplamente estudados por métodos de extração por solventes [5–7]. (E)-β-Ocimeno é o único produto químico volátil identificado produzido por larvas operárias vivas. Há evidências da existência de outros voláteis larvais, porque diferentes picos de cromatograma além do (E)-β-ocimeno foram descobertos [8], mas suas composições não são claras. Também há falta de informações sobre como esses voláteis larvais desconhecidos mudam com o desenvolvimento larval.
Aqui está a tradução do texto:
No entanto, é necessário compreender a composição e variação do conteúdo de voláteis durante o desenvolvimento larval para interpretar suas funções.
A comida fornecida às abelhas pode afetar diretamente ou indiretamente a produção de voláteis das abelhas. Há evidências de que a escassez de alimentos pode estimular larvas de abelhas operárias a liberar mais (E)-β-ocimeno [9], e alimentar larvas de abelhas operárias com óleos essenciais através de suplementos dietéticos pode alterar seus voláteis [10]. No entanto, os voláteis extraídos do alimento larval de abelhas operárias não foram relatados. Apenas ácidos carboxílicos voláteis foram identificados no alimento larval de zangão, e outros voláteis não ácidos não identificados foram notáveis [11].
Se os voláteis do alimento larval de abelhas operárias fossem analisados e combinados com a análise de voláteis das larvas operárias, isso forneceria uma compreensão profunda da relação entre os voláteis nas larvas e seu alimento durante o mesmo ínstar larval.
Neste artigo, analisamos os voláteis de larvas operárias e seu alimento em diferentes ínstares, usando extração dinâmica em fase sólida (SPDE) combinada com cromatografia gasosa de alta resolução acoplada à espectrometria de massas em tandem (GC-MS). Através desta pesquisa, descobrimos novos voláteis associados ao desenvolvimento de larvas operárias e seu alimento que foram previamente ignorados.
- Materiais e Métodos
Três linhagens comerciais padrão chinesas de abelhas europeias (Apis mellifera ligustica L.) foram utilizadas neste experimento. Colônias grandes de dois níveis (30.000 a 50.000 abelhas adultas) foram localizadas em nosso apiário no Instituto de Pesquisa Apícola em Pequim (39° N, 116,2° E). As rainhas foram enjauladas dentro de controladores de plástico (dimensões internas: 457 × 50 × 245 mm, permitindo apenas a passagem de abelhas operárias) para ovopositar em novos favos vazios (sem reservas de pólen e néctar) por 24 horas e então foram removidas para fora dos controladores. Os favos de ovoposição foram mantidos nos controladores. Em cada intervalo de enjaulamento, obtivemos três favos com coortes de idades únicas de larvas operárias. Os eventos de enjaulamento foram realizados sete vezes, totalizando 21 favos.
Após os favos serem trazidos de volta ao laboratório, células foram escolhidas aleatoriamente para fornecer tanto o alimento larval quanto amostras de larvas para análises adicionais. As larvas e o alimento larval foram obtidos com uma pequena espátula. As larvas foram inspecionadas sob o microscópio, e apenas larvas vivas e não feridas foram utilizadas para o estudo [9].
2.1. Tratamentos
Os voláteis de larvas agrupadas em três estágios de desenvolvimento foram monitorados. Os tamanhos dos grupos foram de 20 larvas do segundo ínstar (2º ínstar), 10 larvas do quarto ínstar (4º ínstar) e 10 larvas do quinto ínstar (5º ínstar). Os voláteis do alimento larval também foram detectados em diferentes estágios. Para monitorar as mudanças nos voláteis com relação à ontogenia, a quantidade de voláteis liberados por larva individual foi determinada [8].
Para comparar o conteúdo de voláteis entre larvas e alimento, a quantidade de voláteis liberados por unidade de peso da amostra foi calculada [12]. As larvas e o alimento foram cuidadosamente transferidos para frascos de vidro de 20 mL. Antes da análise, 2 µL de solução de hexadecano em hexano a 0,1 mg/L em uma tira de papel de filtro foram adicionados como padrão interno para quantificação. Frascos vazios limpos foram analisados separadamente como controles para remover interferências de fundo.
2.2. Sistema SPDE-GC-MS
A extração de voláteis foi realizada usando equipamento SPDE (extração dinâmica em fase sólida) instalado em um autoamostrador CTC-Combi-PAL (CTC Analytics, Zwingen, Suíça), conforme descrito por Castro [13]. A agulha SPDE (SPDE-01/AC-50-56, 50 µm × 56 mm), revestida com 90% de polidimetilsiloxano (PDMS) e 10% de carvão ativado (AC), foi pré-condicionada antes do uso. A equilibração entre a amostra e o espaço de cabeça durou 30 minutos a 35 °C em uma piscina de incubação. Após a equilibração, o procedimento de extração ocorreu da seguinte forma: um volume de extração de 1 mL, temperatura do agitador de 35 °C, temperatura da seringa de cabeça de 35 °C, -30 golpes e velocidade de preenchimento/ejeção de 25 µL/s. Durante o procedimento de equilibração e extração, as larvas estavam vivas e isoladas do alimento por mais de 45 minutos [9]. A agulha foi então retirada e introduzida na porta de injeção do cromatógrafo gasoso, e bombeada com 1 mL de nitrogênio a 100 µL/s para dessorção e a 250 °C por 2 minutos em modo splitless.
A análise GC-MS foi realizada usando um Cromatógrafo a Gás Shimadzu-2010 equipado com uma coluna capilar DB-5ms (30 m × 0,25 mm × 0,25 µm; J&W Scientific, Folsom, CA, EUA) acoplada a um Espectrômetro de Massas Quadrupolo Shimadzu-2010 (Shimadzu, Kyoto, Japão). O programa do forno foi o seguinte: 35 °C por 2 minutos, 35–200 °C a 5 °C/min, 200 °C por 2 minutos, 200–250 °C a 10 °C/min, e então 250 °C por 3 minutos. A temperatura do injetor foi mantida a 250 °C, a temperatura da linha de transferência foi de 250 °C, e a temperatura da fonte de íons foi de 200 °C. Hélio foi usado como gás de arraste, a uma taxa de fluxo de 1,7 mL/min.
2.3. Análise Qualitativa e Quantitativa
A identificação do composto com padrões autênticos foi realizada comparando os espectros de massa (Wiley6 e NIST05) e os tempos de retenção com os dos padrões autênticos. Compostos sem padrões foram identificados comparando os picos de espectro de massa com bibliotecas do sistema de dados (Wiley6 e NIST05) e outros espectros publicados (Centro de Dados de Espectrometria de Massa 1974). Além disso, os índices de retenção linear (LRI) dos compostos foram calculados injetando uma série de n-alcanos (C10-C25) (o2si Smart Solutions) no GC-MS em duas colunas de polaridades diferentes sob condições idênticas. Padrões autênticos (listados nos Dados Suplementares, Tabela S1) adquiridos da Alfa Aesar (Karlsruhe, Alemanha) foram diluídos seriamente com hexano para fazer soluções padrão. As áreas de pico no cromatograma de íons totais foram usadas para quantificação. A curva de calibração derivada de uma série de passos de compostos padrão para compostos alvo individuais foi construída plotando a razão da área dos compostos alvo para o padrão interno contra a razão de concentração. As concentrações de compostos voláteis foram calculadas com base nas curvas de calibração correspondentes.
2.4. Análise Estatística
A análise de componentes principais (PCA) usando uma matriz de correlação foi aplicada
aos dados para estabelecer relações entre as diferentes amostras e seus compostos voláteis. O pacote de software SPSS Versão 21 para Windows (SPSS, Chicago, IL, EUA) foi utilizado para análise estatística. Uma ANOVA de um fator (p < 0,05) foi usada para testar diferenças significativas nas concentrações de compostos voláteis entre tratamentos. Figuras foram criadas usando o SigmaPlot versão 12 para Windows (Systat Software Inc., San Jose, CA, EUA).
- Resultados
Detectamos quinze compostos nas larvas em desenvolvimento e em seu alimento correspondente, que poderiam ser classificados em sete grupos: três aldeídos, um éster, três hidrocarbonetos, um cetona e sete terpenoides (Figura 1, Tabela 1).
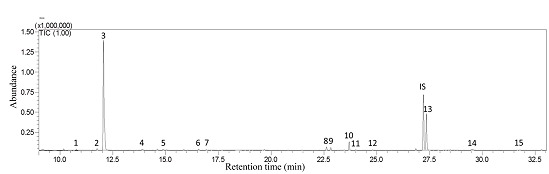
Figura 1. Cromatograma gasoso de todos os voláteis identificados refletidos nas larvas de 2º ínstar (IS: padrão interno)
| RT | Composto | Código | Pico | LRI Calculado | LRI Literatura | Identificação | Íons Diagnósticos | |
|---|---|---|---|---|---|---|---|---|
| 11.75 | (Z)-β-Ocimeno | t1 | 2 | 1040 | 1229 | S | N | |
| 12.06 | (E)-β-Ocimeno | t2 | 3 | 1050 | 1250 | S | N | |
| 14.61 | (E, Z)-Alloocimeno | t3 | 5 | 1134 | 1371 | N | L | |
| 16.56 | α-Terpineol | t4 | 6 | 1199 | 1143 | S | N | |
| 22.62 | α-Cedreno | t5 | 8 | 1421 | 1556 | 1403 | N | |
| 22.82 | α-Cedreno | t6 | 9 | 1429 | 1560 | 1403 | N | |
| 27.34 | Cedrol | t7 | 13 | 1615 | 2112 | 1543 | N | |
| 10.73 | Octanal | a1 | 1 | 1008 | 1005 | S | N | |
| 13.48 | Nonanal | a2 | 4 | 1109 | 1004 | S | N | |
| 16.91 | Decanal | a3 | 7 | 1212 | 1204 | S | N | |
| 24.80 | Pentadecano | h1 | 12 | 1508 | 1498 | 1512 | S | |
| 29.48 | Heptadecano | h2 | 14 | 1709 | 1699 | 1711 | S | |
| 31.77 | Octadecano | h5 | 15 | 1816 | 1799 | 1852 | S | |
| 27.38 | Etil 2(E)-decenoato | e1 | 11 | 1489 | 1758 | 1389 | N | |
| 23.65 | (S)- (E)-Geranilacetona | k1 | 10 | 1454 | 1420 | N | L |
LRI: Índice de Retenção Linear
S: Sim
N: Não
L: Sim, com limitações
Tabela 1. Compostos voláteis identificados provisoriamente em larvas e alimento larval em diferentes ínstares larvais.
a RT: Tempo de retenção (min); b Código: antonomásia do composto; c LRI Calc: Índice de retenção linear calculado através de n-alcanos; d LRI Nis: Índice de retenção linear relatado no NIST Chemistry Web Book 2005; e A confiabilidade da identificação ou proposta estrutural é indicada da seguinte forma: (S) espectro de massa e tempo de retenção consistentes com os de um padrão autêntico; (N) propostas estruturais com base em dados espectrais de massa (NIST98); (L) espectro de massa consistente com espectros encontrados na literatura. DB5: tipo de coluna capilar; BPX5: tipo de coluna capilar.
3.1. Voláteis
3.1.1. Terpenoides
Os terpenoides foram o grupo mais abundante coletado das larvas, exceto no 5º ínstar, representando 83,3% e 73,7% do total de voláteis larvais no 2º e 4º ínstares, respectivamente, calculados em ng/mg. Os principais terpenoides dos voláteis do alimento foram α-cedreno (t5) e cedrol (t7), representando 65,5–89,2% do total de terpenoides, enquanto o principal terpenoide das larvas foi (E)-β-ocimeno (t2), representando 60,9–93,8% do total de terpenoides.
O peso larval aumentou com o desenvolvimento larval (Figura 2), mas houve uma diminuição contínua em (E)-β-ocimeno (Figura 3, coluna t2), α-terpineol (Figura 3, coluna t4) e terpenoides totais (Figura 3, coluna St) quando a quantidade de terpenoides foi calculada em ng/larva individual. Dois compostos desapareceram completamente no 5º ínstar: (Z)-β-ocimeno (Figura 3, coluna t1) e (E, Z)-aloocimeno (Figura 3, coluna t3). Não foram observadas diferenças significativas entre os ínstares para α-cedreno (Figura 3, coluna t5) e β-cedreno (Figura 3, coluna t6). A quantidade de cedrol (Figura 3, coluna t7) aumentou abruptamente do 2º ao 4º ínstar e permaneceu estável do 4º ao 5º ínstar.
Quando a quantidade de terpenoides (St, t1, t2, t3, t4, t5, t6, t7) liberada pela larva foi calculada em ng/mg (Figura 3), houve uma tendência decrescente durante o desenvolvimento larval. As larvas do 2º ínstar sempre tiveram teores significativamente mais altos do que as larvas em outros ínstares. Quando a quantidade de terpenoides no alimento larval foi calculada em ng/mg, a quantidade detectável de terpenoides mudou insignificativamente entre os ínstares.
Ao comparar o conteúdo em larvas e alimento no mesmo estágio em ng/mg, as larvas apresentaram uma quantidade significativamente maior de terpenoides do que o alimento no 2º ínstar, exceto α-cedreno, β-cedreno e cedrol. No 2º ínstar, os teores de α-cedreno e β-cedreno foram insignificantes entre larva e alimento; o teor de cedrol foi significativamente menor nas larvas do que no alimento. No 4º ínstar, as larvas ainda apresentaram um teor significativamente maior de (E)-β-ocimeno do que o alimento; a diferença no teor de (Z)-β-ocimeno foi insignificante entre larvas e alimento. Para outros compostos terpenoides, as larvas apresentaram teores substancialmente mais baixos do que o alimento após o 2º ínstar.
Figura 2. Mudanças no peso da larva durante o desenvolvimento larval.
Figura 3. Terpenoides e aldeídos extraídos de larvas e alimento larval em diferentes ínstares larvais. N > 10 para cada grupo; as barras de erro representam erros padrão, letras diferentes e ‘’ no topo das barras indicam diferença significativa no nível de 0,05, ‘*’ no nível de 0,01 sob o teste PLSD de Fisher, após ANOVA mostrou um efeito significativo. Barras que compartilham uma letra sobrescrita não são significativamente diferentes.
3.1.2. Aldeídos
Os aldeídos estavam em concentrações mais altas no alimento (25,4–59,6%) do que nas larvas (7,9–22,3%) quando calculados em ng/mg. O nonanal (a2) foi o aldeído mais abundante em cada amostra, representando 65,3–93,3% do total de aldeídos, seguido pelo decanal (a3) e octanal (a1).
Octanal (Figura 3, coluna a1) foi detectado apenas em larvas no 2º ínstar, mas estava presente no alimento em todos os estágios. Nonanal (Figura 3, coluna a2) e decanal (Figura 3, coluna a3) foram detectados tanto em larvas quanto no alimento em todos os estágios. Quando calculados por ng/larva individual, o teor de cada aldeído e o teor total de todos os aldeídos (Figura 3, coluna Sa) não apresentaram mudanças significativas (p > 0,05) com o aumento acentuado do peso corporal larval (Figura 2). No entanto, quando calculados em ng/mg, ambos os parâmetros foram significativamente mais altos em larvas no estágio de 2º ínstar do que em outros estágios. Ao comparar ambos os parâmetros em larvas e alimento no mesmo estágio em ng/mg, não houve diferença significativa no 2º ínstar, enquanto nos outros estágios o alimento continha maior teor de aldeído do que as larvas (p < 0,01). As tendências no conteúdo de aldeídos no alimento foram semelhantes. Houve flutuações durante o desenvolvimento larval, mas não ocorreram diferenças significativas.
3.1.3. Hidrocarbonetos
A quantidade de hidrocarbonetos em comparação com o conteúdo total de voláteis no alimento foi a terceira mais alta após terpenoides e aldeídos, quando calculados em ng/mg. Pentadecano (Figura 4, coluna h1) e heptadecano (Figura 4, coluna h2) foram os hidrocarbonetos que representaram a maioria dos hidrocarbonetos (69,7–88,1%).
Quando calculados por ng/larva individual, o conteúdo de hidrocarbonetos geralmente aumentou durante o desenvolvimento larval. A larva do 2º ínstar apresentou o menor teor de cada hidrocarboneto e o menor teor total de hidrocarbonetos em geral. No entanto, a situação se reverteu ao calcular em ng/mg. A larva do 2º ínstar apresentou um teor significativamente maior do que outras larvas e não houve diferença significativa entre outros ínstares. O alimento no 2º ínstar também apresentou um teor maior do que o alimento em outros ínstares, h2 significativamente, h1 e h3 insignificativamente. Ao comparar o conteúdo em larvas e alimento no mesmo estágio por ng/mg, as diferenças sempre foram significativas, exceto no 2º ínstar. As larvas apresentaram um teor substancialmente menor de hidrocarbonetos do que o alimento.
A Figura 4 mostra hidrocarbonetos e outros voláteis menores extraídos de larvas e alimentos larvais em diferentes estágios larvais. N > 10 para cada grupo; as barras de erro representam os erros padrão, letras diferentes e ‘‘ sobre as barras indicam diferença significativa no nível de 0,05, ‘*’ no nível de 0,01 no teste PLSD de Fisher, após ANOVA mostrar um efeito significativo. Barras com a mesma letra sobrescrita não são significativamente diferentes.
3.1.4. Éster
O etil 2(E)-decenoato (Figura 4, coluna e1) foi o único éster detectado antes do 5º instar. Este éster foi significativamente maior no 4º instar do que no 2º instar quando calculado em ng/larva individual (p = 0,02). A tendência foi revertida quando calculado em ng/mg. Houve poucas mudanças no alimento dos diferentes instares. No 2º instar, as larvas tinham um conteúdo significativamente maior do que o alimento, mas houve um conteúdo significativamente menor no 4º instar.
3.1.5. Cetona
(E)-Geranilacetona (Figura 4, coluna k1) foi a única cetona detectada neste experimento. Quando calculado em ng/larva individual, as larvas do 5º instar apresentaram conteúdo significativamente maior do que as larvas nos outros instares, que tinham níveis comparáveis. Quando calculado em ng/mg, as larvas do 2º instar tinham conteúdo significativamente maior do que as larvas nos outros instares. O alimento dos vários instares continha níveis comparáveis de (E)-geranilacetona. Ao comparar o conteúdo em larvas e alimento no mesmo estágio em ng/mg, as larvas tinham conteúdos substancialmente maiores do que o alimento no 2º instar, enquanto o oposto era verdadeiro nos outros estágios.
3.2. Análise de Componentes Principais
A Análise de Componentes Principais (PCA) foi realizada para revelar as relações entre as amostras (pontuações) e seus compostos voláteis (cargas) (Figura 5). Um total de 96 amostras e 15 compostos foram utilizados (Medida de Adequação da Amostragem de Kaiser-Meyer-Olkin: 0,731; Teste de Esfericidade de Bartlett: p < 0,01). A maioria das informações está contida nos dois primeiros PCs e representa 62,2% da variação explicada. Um gráfico de dispersão das pontuações da PCA (Figura 5A) mostra a distribuição das amostras, e o gráfico de cargas correspondente (Figura 5B) mostra os voláteis em larvas e alimentos em diferentes estágios de desenvolvimento. A combinação desses resultados permite a interpretação das relações entre as amostras e seus compostos.
As análises mostram diferenças claras nos perfis voláteis das larvas e no perfil volátil do alimento. Os dois tipos de amostras foram separados pelo PC2. A maioria das amostras de alimento tinha pontuações positivas no PC2, atribuíveis à contribuição dos aldeídos (a1, a2, a3), hidrocarbonetos (h1, h2, h3) e dois terpenoides (t5, t7). Além disso, todas as amostras larvais tinham pontuações negativas no PC2, impulsionadas pela maioria dos terpenoides (t1, t2, t3, t4, t6), um éster (e1), uma cetona (k1).
Amostras do mesmo tipo foram distinguidas pelo PC1 de acordo com os estágios de desenvolvimento. Tanto as amostras larvais quanto as de alimento geralmente mudaram de positivas para negativas ao longo do eixo PC1, do 2º ao 5º instar. As amostras de larvas do 2º instar localizadas no quarto quadrante foram essencialmente caracterizadas pelos compostos distribuídos nesse quadrante, especialmente terpenoides. As larvas nos outros instares estavam localizadas no terceiro quadrante, implicando que os voláteis desses estágios eram altamente conservados e em níveis relativamente baixos. Parte do alimento dos instares 2º e 4º localizados no primeiro quadrante foi principalmente caracterizada pelos compostos distribuídos nesse quadrante, especialmente aldeídos e hidrocarbonetos. O restante das amostras de alimento estava localizado no terceiro quadrante, com pontuações baixas no PC.
Figura 5. Posições das pontuações de PC das amostras, incluindo larvas e alimentos larvais em diferentes instares larvais (2º: 2º instar, 4º: 4º instar e 5º: 5º instar). (A): Gráfico de dispersão de pontuações da análise de componentes principais (PCA). (B): Gráfico de cargas da PCA. Os códigos em (B) correspondem aos códigos de compostos listados na Tabela 1.
- Discussão
Os terpenoides foram previamente relatados como produtos característicos da glândula Nasanov de abelhas operárias e incluem nerol, geraniol, (E) e (Z)-citrals, ácido nerólico, ácido gerânico e (E, E)-farnesol [14]. (E)-β-Ocimeno pode ser emitido por rainhas fecundadas estabelecidas [4]. No presente estudo, descobrimos que os terpenoides são os principais constituintes das larvas de abelhas operárias. Larvas e alimentos no 2º instar apresentaram maior similaridade de peso de substância seca por unidade de volume em comparação com outros estágios. Supondo que larvas e alimentos no 2º instar tivessem densidades semelhantes, as larvas teriam liberado uma quantidade significativamente maior de terpenoides do que o alimento; portanto, esses terpenoides, como (Z)-β-ocimeno, (E)-β-ocimeno, (E, Z)-alloocimeno e α-terpineol, provavelmente foram produzidos pelas larvas. Alguns sintases de terpeno foram identificados em larvas [9]. A concentração de terpenoides poderia ser diluída em larvas mais velhas porque o fluido corporal representa a maior parte de seu peso. Nessas condições, os teores de terpenoides nas larvas ainda eram significativamente maiores do que nos alimentos, sugerindo que compostos como (Z)-β-ocimeno, (E)-β-ocimeno (t2) e (E, Z)-alloocimeno poderiam ser identificados como voláteis larvais. (E)-β-Ocimeno foi determinado como feromônio larval de operárias em um estudo anterior [12]. (Z)-β-Ocimeno e α-terpineol não foram relatados como voláteis de abelhas, mas foram indicados como feromônios em outros insetos. (Z)-β-Ocimeno pode ser liberado por machos chamadores da mosca-das-frutas-do-Caribe (Anastrepha suspensa) [15]; α-Terpineol é relatado como um composto do feromônio de agregação produzido por machos do percevejo soldado espinhoso (SSB) Podisus maculiventris [16].
(Z)-β-Ocimeno, (E)-β-Ocimeno e (E, Z)-alloocimeno foram uma vez relatados como componentes do óleo essencial de Tagetes minuta, que é altamente letal para V. destructor [17]. O α-terpineol demonstrou ter um efeito repelente sobre o ácaro em um ensaio de laboratório e pode, portanto, reprimir sua entrada nas células de criação de colmeias [18]. Esses terpenoides podem ser importantes no controle de V. destructor.
Existem sesquiterpenos identificados como feromônios. (E)-β-Farneseno é um feromônio de alarme de pulgões [19]. Neste estudo, o cedrol é um sesquiterpeno identificado tentativamente com funcionalidade de álcool terciário. Esse álcool pode ser facilmente eliminado para dar misturas de α- e β-cedreno, esses sesquiter
penos podem ser coletados por abelhas de resina e pólen de Cedrus deodara plantados próximo ao apiário.
Todos os aldeídos detectados neste estudo foram previamente relatados como feromônio de chamada de machos de Galleria mellonella [20] e voláteis de colmeias. Os aldeídos são emitidos por abelhas operárias adultas [21] e rainhas virgens [22] e estão presentes em favos de criação fechados contendo larvas ativas e operárias presentes [1]. Nossos resultados mostraram que o conteúdo de aldeído por peso unitário era maior no alimento larval do que nas larvas. Isso apoia a suposição de que os aldeídos são secretados por abelhas operárias, porque o alimento larval é um material manipulado por abelhas operárias. Isso é consistente com as descobertas de Torto et al. [23], que relataram esses aldeídos no pólen. O resultado também explica por que o conteúdo de aldeído no alimento não mostrou flutuações significativas durante o desenvolvimento larval. O conteúdo de aldeído nas larvas também permaneceu estável, independentemente do crescimento larval, exceto que a1 desapareceu após o 2º instar.
Os hidrocarbonetos têm funções redutoras de transpiração em artrópodes. Eles incluem hidrocarbonetos lineares e ramificados, saturados e insaturados, com diferentes números de átomos de carbono variando de 15 a 35 [24]. Alguns desses compostos funcionam no reconhecimento de coirmãos e aceitação social [25]. O pentadecano foi relatado como volátil larval [26]. Foi detectado em abelhas enfermeiras [27] e rainhas no momento da decolagem [28], juntamente com o heptadecano. O octadecano é encontrado na cera do favo, com abelhas operárias tratadas com esse composto se tornando menos aceitáveis para suas companheiras de ninho não tratadas [29]. É liberado pela traça clara (Paranthrene diaphana) como feromônio sexual feminino [30]. Se assumirmos que os hidrocarbonetos cuticulares têm uma distribuição uniforme e constante na superfície das larvas, o conteúdo de hidrocarboneto deve aumentar com o volume larval. Um relatório anterior indicou que o nível de tricosano e pentacosano aumentaria com o desenvolvimento larval de zangões [31]. No presente estudo, o conteúdo de hidrocarboneto aumentou em diferentes graus em larvas individuais durante o desenvolvimento larval. Em certa medida, isso fornece outro suporte para a hipótese. No alimento, o conteúdo de hidrocarboneto mostrou diferentes graus de diminuição por peso unitário. Isso sugere que a produção de hidrocarbonetos no alimento é independente da produção em larvas. Em outras palavras, os hidrocarbonetos no alimento são influenciados pelo provedor de alimentos, enquanto os hidrocarbonetos nas larvas são afetados pelas próprias larvas.
Os ésteres alifáticos são conhecidos como outro grupo de feromônios secretados por insetos. Por exemplo, o acetato de etila é um feromônio masculino produzido pela mosca-da-fruta do Mediterrâneo (Ceratitis capitate) [32]. Ésteres de acetato e propionato são encontrados no reservatório da glândula de veneno de Myrmecina graminicola [33]. Em colônias de abelhas, o éster alifático é também ubíquo. Decil decanoato é secretado por rainhas virgens da glândula tergal; o oleato de etila é produzido por abelhas forrageiras, suprimindo o início de forrageamento entre abelhas mais jovens. Ésteres etílicos e metílicos de ácidos palmítico, linoleico, linolênico, esteárico e oleico são feromônios de criação que mediam a comunicação entre cria e abelhas operárias [14]. O etil 2(E)-decenoato é identificado tentativamente em abelhas operárias pela primeira vez no presente estudo. O etil 2(E)-decenoato foi identificado tentativamente como um dos principais compostos de iscas de açúcar fermentado para espécies de lepidópteros resultantes da decomposição do açúcar durante o processo de fermentação [34].
(E)-Geranilacetona foi previamente identificada como volátil de rainha [28], feromônio sexual produzido por machos do besouro cerambicídeo (Hedypathes betulinus) [35] e feromônio de agregação produzido por machos do besouro longo da abetarda marrom (Tetropium fuscum) [36]. As concentrações deste composto em larvas não mostraram mudanças óbvias com o crescimento de larvas individuais, e as concentrações mostraram apenas um aumento dramático durante o estágio de fechamento (5º instar). Não foram encontradas diferenças significativas nas concentrações deste composto em alimentos em diferentes estágios. Isso pode sugerir que o composto é liberado pelas larvas para um papel específico neste período particular.
Ao rastrear as origens dos voláteis de larvas operárias e alimentos larvais, os seguintes fatores precisam ser considerados no futuro: os voláteis das abelhas operárias adultas, a matriz dentro da colmeia (como mel, pólen, própolis e cera) e até mesmo as plantas fora da colmeia publicadas por outros estudos baseados na mesma localidade. Além disso, a constância dos componentes voláteis em amostras de larvas operárias de diferentes localidades deve ser estabelecida. Além disso, mais análises qualitativas devem ser realizadas nos voláteis identificados tentativamente. Finalmente, apenas um método de extração foi aplicado neste estudo, e o uso de métodos de extração ou detecção mais avançados para voláteis de larvas operárias pode revelar compostos adicionais.
- Conclusões
Nossos resultados mostram que voláteis podem ser identificados em larvas operárias de abelhas e seus alimentos, além de (E)-β-ocimeno. Fornecemos evidências de que esses voláteis mudam e seguem certas regras de mudança durante o desenvolvimento larval. O presente estudo deve fornecer uma base para pesquisas futuras sobre o mecanismo molecular dos voláteis e para a verificação do papel dos componentes identificados.
Referências
⦁ Carroll, M.J.; Duehl, A.J. Coleta de voláteis de larvas de abelhas e adultos confinados em quadros de criação. Apidologie 2012, 43, 715–730. [CrossRef]
⦁ Breed, M.D.; Guzman-Novoa, E.; Hunt, G.J. Comportamento defensivo de abelhas melíferas: organização, genética e comparações com outras abelhas. Annu. Rev. Entomol. 2004, 49, 271–298. [CrossRef] [PubMed]
⦁ Janson, S.; Middendorf, M.; Beekman, M. Enxames de abelhas: como as exploradoras guiam um enxame de abelhas desinformadas? Anim. Behav. 2005, 70, 349–358. [CrossRef]
⦁ Gilley, D.C.; DeGrandi-Hoffman, G.; Hooper, J.E. Compostos voláteis emitidos por rainhas vivas de abelha europeia (Apis mellifera L.). J. Insect Physiol. 2006, 52, 520–527. [CrossRef]
⦁ Le Conte, Y.; Arnold, G.; Trouiller, J.; Masson, C.; Chappe, B. Identificação de uma feromona de criação em abelhas melíferas. Naturwissenschaften 1990, 77, 334–336. [CrossRef]
⦁ Rickli, M.; Diehl, P.A.; Guerin, P.M. Alcanos cuticulares de larvas de abelhas melíferas mediam a captura do parasita de abelhas Varroa jacobsoni. J. Chem. Ecol. 1994, 20, 2437–2453. [CrossRef] [PubMed]
⦁ Aumeier, P.; Rosenkranz, P.; Francke, W. Voláteis cuticulares, atratividade de larvas operárias e invasão de células de criação por ácaros Varroa. Uma comparação entre abelhas africanizadas e europeias. Chemoecology 2002, 12, 65–75. [CrossRef]
⦁ Maisonnasse, A.; Lenoir, J.-C.; Costagliola, G.; Beslay, D.; Choteau, F.; Crauser, D.; Becard, J.-M.; Plettner, E.; Le Conte, Y. Nota científica sobre E-β-ocimeno, uma nova feromona volátil que inibe o desenvolvimento dos ovários das operárias em abelhas melíferas. Apidologie 2009, 40, 562–564. [CrossRef]
⦁ He, X.J.; Zhang, X.C.; Jiang, W.J.; Barron, A.B.; Zhang, J.H.; Zeng, Z.J. Larvas famintas de abelhas melíferas (Apis mellifera) sinalizam por feromônios para as operárias. Sci. Rep. 2016, 6, 22359. [CrossRef] [PubMed]
⦁ Sammataro, D.; Finley, J.; LeBlancz, B.; Wardell, G.; Ahumada-Segura, F.; Carroll, M.J. Alimentação com óleos essenciais e 2-heptanona em xarope de açúcar e dietas líquidas de proteínas para abelhas melíferas (Apis mellifera L.) como potenciais controles do ácaro Varroa (Varroa destructor). J. Apic. Res. 2009, 48, 256–262. [CrossRef]
⦁ Nazzi, F.; Milani, N.; Della Vedova, G. Um semioquímico do alimento larval influencia a entrada de Varroa destructor nas células de criação. Apidologie 2004, 35, 403–410. [CrossRef]
⦁ Maisonnasse, A.; Lenoir, J.C.; Beslay, D.; Crauser, D.; Le Conte, Y. E-beta-ocimeno, uma feromona volátil de criação envolvida na regulação social na colônia de abelhas melíferas (Apis mellifera). PLoS ONE 2010, 5, e13531. [CrossRef]
⦁ Castro, L.F.; Ross, C.F.; Vixie, K.R. Otimização de um método de extração dinâmica em fase sólida (SPDE) para perfilagem volátil de cerveja. Food Anal Method 2015, 8, 2115–2124. [CrossRef]
⦁ Trhlin, M.; Rajchard, J. Comunicação química na abelha melífera (Apis mellifera L.): Uma revisão. Vet. Med. 2011, 56, 265–273. [CrossRef]
⦁ Teal, P.E.A.; Meredith, J.A.; Gomez-Simuta, Y. Isolamento e identificação de componentes terpenoides de feromônio sexual de extratos de hemolinfa de machos da mosca-das-frutas-do-Caribe. Arch. Insect Biochem. Physiol. 1999, 42, 225–232. [CrossRef]
⦁ Sant’Ana, J.; Da Silva, R.F.P.; Dickens, J.C. Recepção olfativa do feromônio de agregação conspecífica e odores de plantas por ninfas do predador Podisus maculiventris. J. Chem. Ecol. 1999, 25, 1813–1826. [CrossRef]
⦁ Eguaras, M.J.; Fuselli, S.; Gende, L.; Fritz, R.; Ruffinengo, S.R.; Clemente, G.; Gonzalez, A.; Bailac, P.N.; Ponzi, M.I. Avaliação in vitro do óleo essencial de Tagetes minuta para o controle dos patógenos de abelhas Paenibacillus larvae e Ascosphaera apis, e do ácaro parasita Varroa destructor. J. Essent. Oil Res. 2005, 17, 336–340. [CrossRef]
⦁ Peng, G.; Kashio, M.; Morimoto, T.; Li, T.; Zhu, J.; Tominaga, M.; Kadowaki, T. Repelentes de carrapatos derivados de plantas ativam o canal TRPA1 do ácaro ectoparasita de abelhas Varroa destructor. Cell Rep. 2015, 12, 190–202. [CrossRef] [PubMed]
⦁ Beale, M.H.; Birkett, M.A.; Bruce, T.J.A.; Chamberlain, K.; Field, L.M.; Huttly, A.K.; Martin, J.L.; Parker, R.; Phillips, A.L.; Pickett, J.A.; et al. Feromônio de alarme de pulgões produzido por plantas transgênicas afeta o comportamento de pulgões e parasitoides. Proc. Natl. Acad. Sci. USA 2006, 103, 10509–10513. [CrossRef]
⦁ Lebedeva, K.V.; Vendilo, N.V.; Ponomarev, V.L.; Pletnev, V.A.; Mitroshin, D.B. Identificação de feromônio da traça da cera Galleria mellonella de diferentes regiões da Rússia. IOBC/WPRS Bull. 2002, 25, 229–231.
⦁ Torto, B.; Suazo, A.; Alborn, H.; Tumlinson, J.H.; Teal, P.E.A. Resposta do pequeno besouro da colmeia (Aethina tumida) a uma mistura de compostos identificados nos voláteis de abelhas (Apis mellifera). Apidologie 2005, 36, 523–532. [CrossRef]
⦁ Huang, M.H.; DeGrandi-Hoffman, G.; LeBlanc, B. Comparação dos compostos voláteis de rainhas de abelhas (Apis mellifera) inseminadas instrumentalmente versus naturalmente acasaladas. Apidologie 2009, 40, 464–471. [CrossRef]
⦁ Torto, B.; Arbogast, R.T.; Alborn, H.; Suazo, A.; van Engelsdorp, D.; Boucias, D.; Tumlinson, J.H.; Teal, P.E.A. Composição de voláteis de massa de pólen fermentado e atratividade para o pequeno besouro da colmeia Aethina tumida, um parasita da abelha melífera Apis mellifera. Apidologie 2007, 38, 380–389. [CrossRef]
⦁ Del Piccolo, F.; Nazzi, F.; Della Vedova, G.; Milani, N. Seleção de trabalhadoras de Apis mellifera pelo ácaro parasita Varroa destructor usando hidrocarbonetos cuticulares do hospedeiro. Parasitology 2010, 137, 967–973. [CrossRef] [PubMed]
⦁ Rahman, S.; Hajong, S.R.; Gevar, J.; Lenoir, A.; Darrouzet, E. Compostos de hidrocarbonetos cuticulares em castas de trabalhadoras e seu papel no reconhecimento de companheiras de ninho em Apis cerana indica. J. Chem. Ecol. 2016, 42, 444–451. [CrossRef]
⦁ Nazzi, F.; Della Vedova, G.; D’Agaro, M. Um semioquímico de células de cria infestadas por Varroa destructor desencadeia comportamento higiênico em Apis mellifera. Apidologie 2004, 35, 65–70. [CrossRef]
⦁ Pernal, S.F.; Baird, D.S.; Birmingham, A.L.; Higo, H.A.; Slessor, K.N.; Winston, M.L. Semioquímicos influenciando o comportamento de busca de hospedeiros de Varroa destructor. Exp. Appl. Acarol. 2005, 37, 1–26. [CrossRef] [PubMed]
⦁ Richards, J.; Carr-Markell, M.; Hefetz, A.; Grozinger, C.M.; Mattila, H.R. Voláteis produzidos pela rainha mudam dinamicamente durante o enxameamento reprodutivo e estão associados a mudanças no comportamento de trabalhadoras de abelhas (Apis mellifera). Apidologie 2015, 46, 679–690. [CrossRef]
⦁ Breed, M.D.; Stiller, T.M. Discriminação entre companheiras de ninho em abelhas melíferas, Apis mellifera: Efeitos de hidrocarbonetos e implicações evolutivas na escolha de favos. Anim. Behav. 1992, 43, 875–883. [CrossRef]
⦁ Minaeimoghadam, M.; Askarianzadeh, A.; Imani, S.; Shojaei, M.; Larijani, K.; Abbasipour, H. Identificação de compostos químicos do feromônio em diferentes idades de fêmeas adultas da mariposa Paranthrene diaphana Dalla Torre & Strand. Arch. Phytopatho. Plant Prot. 2017, 50, 1019–1033.
⦁ Wakonigg, G.; Eveleigh, L.; Arnold, G.; Crailsheim, K. Perfis de hidrocarbonetos cuticulares revelam mudanças relacionadas à idade em zangões de abelhas melíferas (Apis mellifera carnica). J. Apic. Res. 2000, 39, 137–141. [CrossRef]
⦁ Jang, E.B.; Light, D.M.; Binder, R.G.; Flath, R.A.; Carvalho, L.A. Atração de fêmeas de mosca-do-mediterrâneo aos cinco principais componentes do feromônio produzido por machos em túnel de voo laboratorial. J. Chem. Ecol. 1994, 20, 9–20. [CrossRef] [PubMed]
⦁ Lenoir, A.; Khalil, A.; Chaline, N.; Hefetz, A. Novos dados químicos sobre a formiga Myrmecina graminicola (Formicidae, Myrmicinae): Abundância incomum de hidrocarbonetos alquênicos e ésteres. Biochem. Syst. Ecol. 2018, 80, 39–42. [CrossRef]
⦁ El-Sayed, A.M.; Heppelthwaite, V.J.; Manning, L.M.; Gibb, A.R.; Suckling, D.M. Constituintes voláteis de iscas fermentadas de açúcar e sua atração para espécies de Lepidópteros. J. Agric. Food Chem. 2005, 53, 953–958. [CrossRef]
⦁ Fonseca, M.G.; Vidal, D.M.; Zarbin, P.H.G. Feromônio sexual produzido por machos do besouro cerambicídeo Hedypathes betulinus: Identificação química e atividade biológica. J. Chem. Ecol. 2010, 36, 1132–1139. [CrossRef]
⦁ Halloran, S.T.; Collignon, R.M.; McElfresh, J.S.; Millar, J.G. Fuscumol e geranilacetona como componentes de feromônio de besouros longicornos da Califórnia (Coleoptera: Cerambycidae) na subfamília Spondylidinae. Environ. Entomol. 2018, 47, 1300–1305. [CrossRef] [PubMed]
© 2019 pelos autores. Licenciado pela MDPI, Basel, Suíça. Este artigo é um artigo de acesso aberto distribuído sob os termos e condições da licença Creative Commons Attribution (CC BY) (http://creativecommons.org/licenses/by/4.0/).
Atendimento
Horário de funcionamento
- De segunda a sexta: 10h às 19h
- (11) 98668-2536 (E-commerce)
- (11) 98331-8545 (Apiterapeuta)
Ajuda
Meus pedidos
Formas de pagamento

Site seguro

- Apisciência
- CNPJ: 50.418.715/0001-37
- © 2024 Todos os direitos reservados.
- Por Mutualcore


